Keramiikan käsikirja
Keramiikan käsikirja
Empiirinen kaava ja raaka-aineiden valinta
Raaka-aineiden sisältämät oksidit jaetaan kolmeen ryhmään:
- Sulattajat RO, jotka ovat emäksiä.
- Tasapainottajat R2O3, jotka ovat neutraaleja.
- Lasinmuodostajat RO2, jotka ovat happoja.
Lasitteen tulee sisältää oksideja kaikista kolmesta ryhmästä. Jokaisella ryhmällä on oma tehtävänsä lasitteen muodostamisessa. Muuttamalla näiden kolmen ryhmän suhdetta toisiinsa säädetään lasitteen ominaisuuksia ja kemiallista koostumusta. Ryhmät ovat nimeltään RO, R2O3 ja RO2. R ei esiinny mikään kemiallisen alkuaineen nimenä, joten se on valittu merkkaamaan oksideja lasitteen kemiallisen koostumuksen kaavassa (empiirinen kaava).
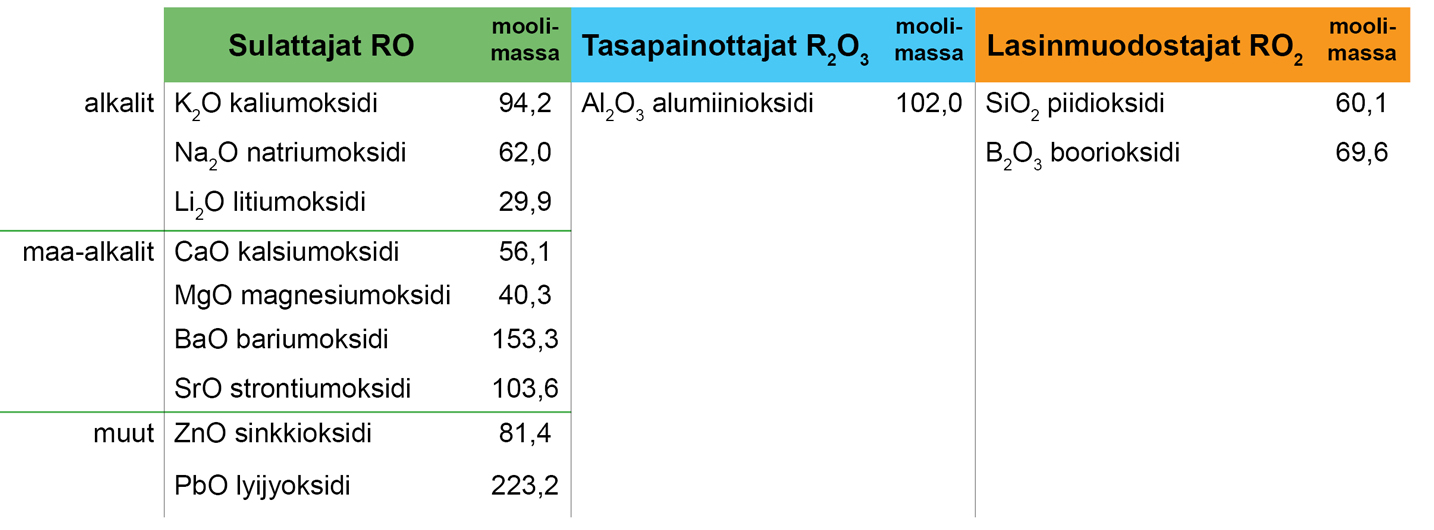
Lasitteeseen valitaan kemiallisen koostumuksen (analyysi tai empiirinen kaava) mukaan sellaisia raaka-aineita, jotka sisältävät toivottuja ominaisuuksia muodostavia oksideja. Ensin valitaan ne raaka-aineet, jotka sisältävät useita eri oksideja (esim. maasälvät ja sulatteet). Seuraavaksi lisätään ne raaka-aineet, jotka sisältävät vain yhtä oksidia (esim. kvartsi, liitu ja sinkkioksidi) ja muodostavat lasitteen tavoitellut ominaisuudet. Boorioksidi B2O3 on poikkeus, joka voi kuulua joko sulattajiin tai lasinmuodostajiin riippuen tilanteesta.
Alla olevassa kuvassa näkyy lasitteen oksidien käyttäytyminen (sulattava, lasia muodostava, tasapainottava, haihtuva) eri lämpötiloissa.

Empiirinen eli Segerin kaava
Empiirinen kaava eli Segerin kaava on
saksalaisen Hermann Segerin kehittämä lasitteen koostumuksen
arviointiin käytettävä laskentakaava, jonka avulla voidaan ennustaa tai
tunnistaa poltetun lasitteen ulkonäköä. Laskukaavaa käytetään empiirisen tutkimuksen työvälineenä ja on kansainvälisesti keramiikan tutkimuksen yhteinen kieli.
Empiirisessä kaavassa poltetun massan tai lasitteen raaka-aineet on jaettu oksideiksi, jolloin niiden tarkka vertaileminen on mahdollista. Kaavasta voi toisinpäin laskea lasitteen tai massan käytetyt raaka-ainemäärät painoprosentteina.
Lasitteen tai massan empiirisen kaavan voi laskea joko käyttämällä raaka-aineen teoreettista kemiallista kaavaa tai valmistajan ilmoittamaa kemiallista analyysiä. Empiirinen kaava on suuntaa-antava, koska lasitteen sulaminen on monen eutektisen reaktion yhdistelmä. Eri valmistajien
raaka-aineiden koostumukset vaihtelevat riippuen siitä mistä maasta kyseisen raaka-aineen mineraali on louhittu. Kalimaasälvän teoreettinen kemiallinen
kaava on K2O · Al2O3 · 6SiO2. Kuitenkin suomalaisen FFF-kalimaasälvän analyysi sisältää mineraalin epäpuhtautena vähän myös
natrium- ja kalsiumoksidia, jolloin sen todellinen kemiallinen kaava on
erilainen kuin teoreettisen.
Empiirisen kaavan laskentaohjelmat käyttävät kaavan laskemiseen raaka-aineen kemiallista analyysiä. Analyysi ilmoittaa raaka-aineen sisältämät oksidit painoprosentteina. Laskennassa käytetään joko raaka-aineen saatavilla olevaa valmistajan analyysiä tai tiedon puuttuessa teoreettista analyysiä.
Empiirisen kaavan laskentaohjelmia ovat mm. Digitalfire Insight, Matrix Glaxe ja
HyperGlaze. Niissä on maksullinen lisenssi. Unit molecular formula eli UMF-menetelmä on yleisesti käytetty ja erilaisia versioita löytyy helposti netistä. Sitä voidaan käyttää myös laskettaessa excel-ohjelmassa. Tällöin saatuja empiirisiä kaavoja voi vertailla toisiinsa.
Empiirisessä kaavassa verrataan kolmen oksideista muodostuvan ryhmän moolimassojen suhteita keskenään. Jotta näin voidaan tehdä, täytyy joku ryhmä vakioda aina saman suuruiseksi. Laskettaessa lasitteen empiiristä kaavaa, on päätetty sulattajien yhteenlasketuksi summaksi 1. Tällöin voidaan tasapainottajan (alumiinioksidi) ja lasinmuodostajan (piidioksidi) määriä verrata keskenään. Jos massasta lasketaan empiirinen kaava, tasataan tasapainottajan eli alumiinioksidin määrä lukuun 1. Massa ilmoitetaan yleensä analyysin muodossa.
Empiiriseen kaavaan laskentaan liittyviä termejä
Mooli on atomien, molekyylien, ionien tms. lukumäärän ilmoittama yksikkö.
Moolimassa lasketaan atomipainosta ja on yhden moolin paino grammoissa. Esimerkiksi yksi mooli kaliumoksidia K2O painaa 94,2 g ja piidioksidia SiO2 eli kvartsia 60,1 g. Piidioksidin SiO2 paino lasketaan piin ja hapen atomipainoista (Si=28,08 + happi O2= 2 x 15,99). Moolimassa on 60,06 = 60,1 g. Moolimassa on aina vakio.
Polttohäviö tarkoittaa poltossa raaka-aineista ja karbonaateista kaasuuntuvia aineita. Yli 1000 °C:n lämpötilassa kaasuuntuvat kidevesi (H2O), hiili (CO, CO2), rikki (SO2, SO3), kloori (Cl), typpi (N) ja fluori (F). Esimerkki: liidun eli kalsiumkarbonaatin kaava on CaCO3. Poltossa hiilidioksidi CO2 poistuu, joilloin jää CaO.
Empiirisen kaavan laskeminen
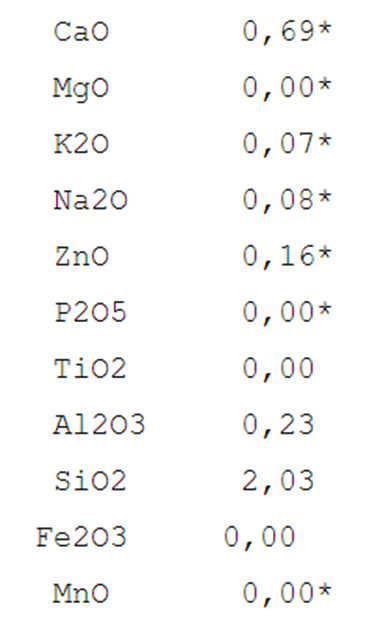
Laskuesimerkkinä käytetään kiiltävä läpikuultavaa korkeanpolton KXX5-lasitetta. Tässä lasitteen prosenttikaava:
- Maasälpä 45 %
- kvartsi 25 %
- liitu 18 %
- kaoliini 6 %
- sinkkioksidi 6 %
Insight-ohjelmalla lasitteelle laskettu empiirinen kaava näyttää tällaiselta. Tähdellä merkityt ovat sulattajia ja niiden yhteenlaskettu summa on 1. Tähdellä merkityt oksidit on syötetty ohjelmaan mutta niitä ei esiinny kaikissa lasitteissa, jolloin luku on 0,00.
Empiirisen kaavan analysointi
Perinteisesti empiirisessä kaavassa esitetään oksidiryhmät rinnakkain. KXX5-lasitteen empiirinen kaava näyttää tältä (Aalto yliopisto 2022):

Empiirisestä kaavasta voidaan päätellä
- lasitteen
pinnan ulkonäkö tarkastelemalla tasapainottajien ja lasinmuodostajien suhdetta toisiinsa.
- Kiiltävä, puolimatta, matta, sulamaton
- suuntaa antavasti lasitteen polttolämpötila.
- värinmuodostusominaisuudet (värimetallioksit + lasitepohja).
- säröilyalttius (alkalioksidit, maa-alkalioksidit).
- Alkalioksidit aiheuttavat maa-alkalioksideja enemmän säröilyä
- läpikuultavuus ja peittävyys.
- Mattapintaa muodostavien oksidien määrä (CaO, MgO, ZnO).
- Mattapintaisissa lasitteissa alkalioksidien (K2O, Na2O ja Li2O) määrä ei voi olla suuri, koska ne ovat erittäin voimakkaita sulattajia.
- Maa-alkalit (CaO, MgO, BaO ja SrO2) muodostavat yksinään isoina määrinä mattapintaa, pieninä määrinä lisäävät lasitteen kiiltoa.
- lasitteen pinnan kovuus tai pehmeys.
- elintarvikekelpoisuus (lyijyoksidin PbO liukenevuus).
Lasitteen sisältämät oksidit sijoittuvat niiden eutektian mukaan tietyille lämpötila-alueille (taulukko alla.) Empiirisen kaavan esimerkki KXX5 ei sijoitu täysin tähän taulukkoon. R2O3-ryhmän (tasapainottajat) ja RO2-ryhmän (lasinmuodostajat) suhteen mukaan lasite sulaa 1000-1200 C. RO-ryhmässä (sulattajat) CaO osuus (0,69) on suuri ja se nostaa lasitteen sulamislämpötilaa ylemmäksi.
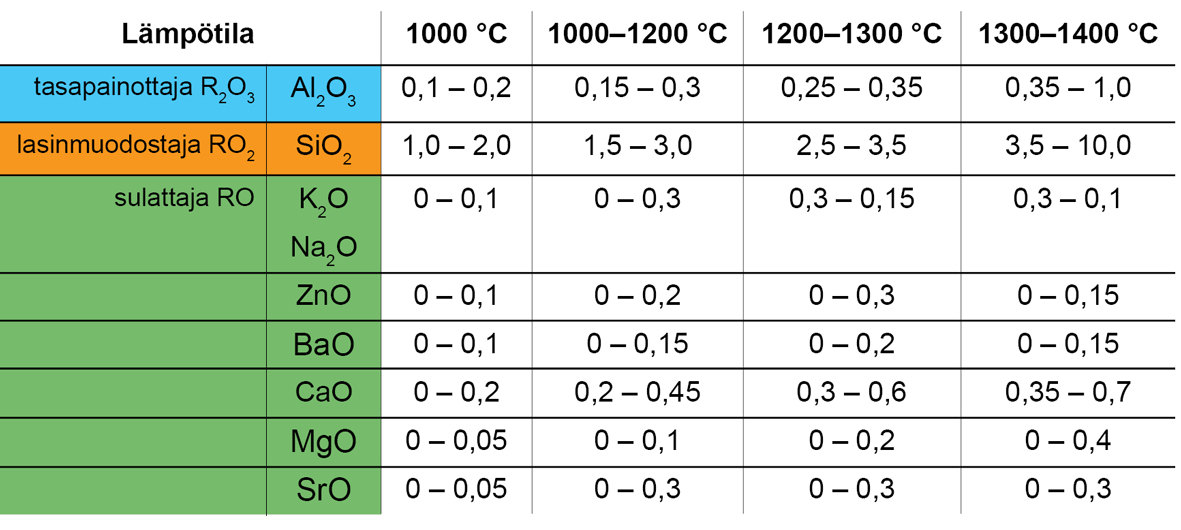
Kuva
Hamer, Frank ja Janet. Lasitteen oksidien käyttäytyminen eri lämpötiloissa.