Keramiikan käsikirja
Värimetallioksidit

Värimetallioksideja käytetään lasitteiden ja massojen värjäämiseen. Niiden värinmuodostusominaisuudet riippuvat lasitteen koostumuksesta, polttolämpötilasta ja -atmosfääristä. Hapettavassa poltossa jotkin värimetallioksidit käyttäytyvät eri tavalla kuin pelkistävässä poltossa. Värimetallioksidit ovat hinnaltaan edullisempi kuin väripigmentit mutta niiden käyttö vaatii perehtymistä. Lasitepinnoista tulee niiden avulla kuitenkin elävämpiä ja mielenkiintoisempia kuin tasaisesti värjäävillä pigmentillä. Useimmat värimetallioksidit ovat myrkyllisiä ja niitä käytettäessä tulee muistaa työturvallisuus eli älä hengitä pölyä ja käytä suojakäsineitä.
Rautaoksidi Fe2O3 ja Fe3O4
Rauta
on maankuoressa yleinen aine ja siksi sitä onkin epäpuhtautena useissa
keramiikan raaka-aineissa. Hapettavassa poltossa Fe2O3 eli punaisen
rautaoksidin väriskaala vaihtelee keltaisesta ruskeaan riippuen sen määrästä
lasitteessa. Mustaa väriä taas tuottavat FeO ja Fe3O4. Rautaoksidi reagoi
helposti eri olosuhteissa, polttotapojen ja raaka-aineiden mukaan. Sillä onkin erittäin
laaja käyttöalue käsittäen matala- ja korkeapolttoiset massat ja lasitukset. Rautaoksidin käytöllä lasitteissa on pitkät perinteet. Tunnetuimpia rautalasitteita ovat temmoku, celadon- ja aventuriinilasitteet.
Rautaoksidin muotoja ja niiden värit jauheena ovat
- Fe2O3 (rauta(III)-oksidi): punaruskea jauheena
- Fe3O4 (rauta(II,III)-oksidi): musta jauheena
- FeO (rauta(II)-oksidi): musta jauheena
- FeCO3 (rautakarbonaatti): ruskea jauheena
- FeTiO3 (rautatitaniitti): musta jauheena
- FeCrO4 (rautakromaatti): tummanharmaa, vesiliukoinen, myrkyllinen
Hapettavassa poltossa on rautaoksidi (sekä punainen että musta) aina punaruskea tai kellertävä riippuen sen määrästä. Lyijy- ja kalsiumoksidia sisältävissä lasitteissa se on keltainen. Pelkistävässä poltossa rautaoksidi muuttuu vihreäksi. Raudan pelkistysväri näkyy harmaana (musta rautaoksidi) tai sinertävän vihreänä. Rautaoksidia sisältäviä lasitteita, jotka muuttuvat eri vihreän sävyisiksi pelkistyspolton vaikutuksesta, kutsutaan celadon-lasitteiksi. Rautaoksidista valmistetaan eri sävyisiä ruskeita pigmenttejä, joita sävytetään mm. sinkkioksidia ja tinaoksidia käyttämällä.
Kobolttioksidi CoO ja CoCO3
Koboltti on yleisin sinisen värin tuottaja keramiikassa. Koboltti on voimakkaasti vaikuttava ja tehokas värioksidi. Pienilläkin määrillä saadaan aikaiseksi koboltille ominainen sininen väri. Kobolttioksidi on sininen eikä reagoi hapettavassa tai pelkistävässä poltossa eri tavoin. Se ei kaasuunnu, vaikka poltetaan 1400oC. Kobolttioksidi (CoO) sulaa yksinään 1800oC lämpötilassa. Koboltti on kova raaka-aine ja se tekeekin lasitteen helposti pilkulliseksi. Pilkullisuutta voi vähentää jauhamalla oksidia hienommaksi ja siivilöimällä lasitetta tai käyttämällä kobolttikarbonaattia oksidin sijaan.
Kobolttioksidia (CoO) saadaan eri muodoissa, joista tavallisimpia ovat: CoO, Co2O3 ja Co3O4. Eri kobolttiyhdisteet sisältävät eri määriä kobolttioksidia, esimerkiksi kobolttikarbonaatti CoCO3 sisältää noin 50 % kobolttioksidia (CoO), jauheena se on väriltään siniharmaata tai siniviolettia.
Kobolttioksidin muotoja ja niiden värit jauheena ovat
- Co2O3 (koboltti (III)-oksidi): musta jauheena, myrkyllinen ja haitallinen
- Co3O4 (koboltti (II,III)-oksidi): musta jauheena, myrkyllinen ja haitallinen
- CoO (koboltti (II)-oksidi): tumman harmaa jauheena, myrkyllinen
- CoCO3 (kobolttikarbonaatti:) siniharmaa tai sinivioletti jauheena, myrkyllinen
- CoCO3.Co(OH)2 H2O (koboltti(II)-hydroksidikarbonaatti): violetti jauheena, myrkyllinen.
- CoCl2.6H2O (koboltti(II)-kloridi): vesiliukoinen, myrkyllinen, haitallinen.
- CoSO4.7H2O (kobolttisulfaatti): vesiliukoinen, myrkyllinen, haitallinen
Hyvin pienet määrät kobolttioksidia vaikuttavat lasitteessa sinisen sävyn syntymiseen. Kobolttia käytetään 0,5–4 %. Kobolttioksidia (2–3 %) voi käyttää eri sävyjä haluttaessa titaanioksidin (7–9 %) kanssa ja sinivihreä kromioksidin (2 %) tai rautaoksidin (3 %) kanssa. Tumma sininen vaatii kobolttioksidia 4–6 %.
Kobolttioksidin sävyt lasitteessa muuttuvat lasitteen sulattajat-ryhmän (RO) mukaan. Myös lasitteen viskositeetti vaikuttaa sinisen sävyn muodostukseen. Lasitteissa, joilla on alhainen viskositeetti ja sulavat läpikuultaviksi ja kiiltäviksi, kobolttioksidi värjää lasitetta voimakkaasti siniseksi. Himmeissä, opaalisissa lasitteissa, joilla on korkea viskositeetti, kobolttioksidin sävy on vaalea. Kobolttioksidi (CoO) toimii sulattavasti lasitteessa, jossa on sulattajina alkaleja, kalium-, natrium- ja litiumoksidia, sekä boorisulatetta sisältävissä lasitteissa. Matalanpolton boorilasitteen kobolttioksidi värjää sinililan sävyiseksi. Lasitteessa sinkkioksidi korostaa sinistä värisävyä, ja magnesiumoksidi (MgO) esimerkiksi vuolukivijauheen tai talkin muodossa kehittää vaalean sinivioletteja pieniä kiteitä lasitepintaan.
Kobolttioksidia kannattaa käsitellä varoen, koska sen hyvin pienet hiukkaset leijuvat käsiteltäessä ympäristöön ja myös uunia ladottaessa käsiin tarttuu kobolttihiukkasia, jotka polton jälkeen näkyvät sinisinä tahroina. Koboltti kaikissa muodoissaan on myrkyllistä. Työturvallisuudessa on huomioitava, että koboltti menee hienojakoisena pulverina ihohuokosiin ja sitä kautta ihmisen kehoon.
Kobolttioksidia käytetään sinisten violettien, harmaiden ja mustien pigmenttien valmistukseen. Siniset kobolttioksidista valmistetut pigmentit voivat olla erittäin korkeapolttoisia, jos kaavassa on käytetty alumiinioksidia. Kobolttioksidilla muokataan vaaleanpunaisesta pigmentistä, kromi- ja tinaoksidiyhdisteestä, violettien eri sävyjä. Kobolttioksidia käytetään myös sinivihreiden ja harmaiden ja mustien pigmenttien sävyttämiseen.Lisätietoa kobolttioksidista löytyy Lisämateriaalit-kansiosta dokumentista Kobolttioksidi.
Kuparioksidi CuO ja CuCO3
Kuparioksidi on monipuolinen väriaine. Sen pääväri on hapettavassa poltossa vihreä mutta siitä voidaan saada useita eri sävyjä, kuten turkoosia ja punaista. CuO metalloituu helposti ja muodostaa silloin sileän mustan mattapinnan, joka on myrkyllinen käyttöesineissä. Pelkistävässä poltossa luovuttaessaan hapen kuparioksidi muuttuu Cu-metalliksi. Tällä tavalla syntyy pelkistyspoltossa punainen häränverilasite. Käytettäessä kuparikarbonaattia korvaamaan kuparioksidia suhde on 1 CuO= 1,75 CuCO3.
Kuparioksidin muotoja ja niiden värit jauheena ovat
- CuO (kupari (II)-oksidi): musta jauheena, myrkyllinen
- CuCO3 (kuparikarbonaatti): vihreä jauheena, myrkyllinen, erittäin haitallinen
- CuCO3.Cu(OH)2 (kupari(II)-hydroksidikarbonaatti): sinivihreä jauheena, myrkyllinen, erittäin haitallinen.
- Cu3 (PO4) 2 (kuparifosfaatti): myrkyllinen
- CuCl (kuparikloridi): myrkyllinen
- CuSO4.5H2O (kupari(II)-sulfaatti): vesiliukoinen, myrkyllinen
Alkalilasitteissa
(kalium-, natrium- ja litiumoksidia sisältävät lasitteet) kuparioksidi
värjäytyy turkoosiksi ja sinivihreäksi. Mitä alkalisempi lasite on sitä
heleämpi turkoosi. Litiumoksidilla pieninäkin määrinä voi muuttaa vihreän
lasitteen turkoosiksi. Kuparin sinivihreää väriä muuttavat maa-alkalioksidit (MgO, CaO, SrO ja BaO) vähäisissä määrissä käytettynä. Lasitepinta muodostaa
pieniä metallisia läikkiä. Kun käytetään bariumkarbonaattia sulattajana (noin 20–30
%), muuttuu lasite paksuna kerroksena 1300 °C asteen poltossa violetiksi.
Kupari haihtuu ja kaasut taltioituvat uunikalustoon haihtuessaan. Uudelleen uunia ladottaessa uunitiilet ovat kyllästetyt kuparihöyryillä edellisen polton jälkeen. Jos poltetaan valkoisia esineitä ne voivat poltossa värjääntyä lievästi vihertäviksi, mikä osoittaa, että ne olisivat valkoisempia kuin mitä alkuperäinen massan väri ilman kuparihöyryjä. Kupari on myrkyllistä kaikissa muodoissaan.
Kromioksidi Cr2O3
Kromioksidia voidaan käyttää sekä alhaisissa että korkeissa lämpötiloissa. Lasitteen koostumuksesta ja polttolämpötilasta riippuen voidaan saada erilaisia sävyjä. Kromioksidista saatava neljä tärkeintä väriä ovat ruohonvihreä, sitruunankeltainen, kirkkaan punainen ja voimakas vaaleanpunainen. Keramiikassa käytetään kromioksidia Cr2O3, joka on vihreä jauhe. Muita kromiyhdisteitä ei tule käyttää työturvallisuussyistä. Useimmat muut kromioksidin muodot ovat jollakin tavoin veteen liukenevia ja myrkyllisiä. Kromioksidi ei sula lasitteissa mutta se höyrystyy herkästi lämpötilan kohotessa yli 1100 °C asteen.
Kromioksidin muotoja ja niiden värit jauheena ovat
- Cr2O3 (kromi(III)-oksidi): vihreä jauheena, myrkyllinen
- PbCrO4 (lyijykromaatti): keltainen, myrkyllinen
- K2Cr2O4 (kaliumdikromaatti): punakeltainen jauheena, myrkyllinen, vesiliukoinen
- FeCr2O4 (rautakromaatti): ruskeanharmaa jauheena, myrkyllinen
- CrO3 (krom(IV)-oksidi): punakiteinen, erittäin vesiliukoinen, myrkyllinen ja syövyttävä
Kromi
on vihreä kivitavarapolton lämpötiloissa kalkkipitoisissa lasitteissa sekä
vaaleanpunainen tinaoksidin kanssa käytettynä hyvin tasoittuvassa lasitteessa.
Lasitteessa, jossa on kalsiumoksidia (CaO) ja tinaoksidia (SnO2), saadaan
kromioksidista vaaleanpunaista sekä viininpunaista.
Kromioksidista tulee voimakas ruohonvihreä väri kalkkipitoisissa lasitteissa. Kalkkipitoisia lasitteita ovat sellaiset lasitteet, joiden empiirisen kaavan RO-ryhmässä on CaO:ta yli 0,5. Kun lasitteessa on sinkkioksidia (ZnO), se muuttaa kromioksidin värin ruskehtavaksi.
Kromioksidia käytetään hyvin monen väripigmentin valmistukseen. Kromioksidiyhdisteet suosivat kalsiumpitoisten lasitteiden käyttöä. Ne voimistavat vihreiden pigmenttien sävyjä. Kromioksidista valmistetaan tinaoksidin kanssa vaaleanpunaiset värisävyt, joita käytetään pinkkien, viininpunaisten ja erisävyisten violettien peruspigmentteinä. Kromioksidia käytetään mustien pigmenttien sävyttämiseen aikaansaamaan mustuutta.
Mangaanioksidi MnO2
Mangaanioksidista saadaan punaruskeaa ja violettia väriä ja se pehmentää tai sävyttää useita värejä punertavan ruskeaksi. MnO2 on voimakas sulattaja ja liukenee lasitteeseen mitä korkeampaan lämpötilaan se poltetaan. Mikäli halutaan sama värisävy eri polttolämpötiloissa, on mangaanioksidin määrää lisättävä korkealle poltettaessa. Muiden sulattavien oksidien kanssa mangaanioksidi edistää lasitteessa sulamisreaktiota. Mangaanioksidia käytetään sekä matalissa että korkeissa lämpötiloissa.
Mangaanioksidin muotoja ja niiden värit jauheena ovat
- MnO2 (mangaanidioksidi): musta jauheena, myrkyllinen
- MnCO3 (mangaanikarbonaatti): ruskea tai violetinruskea jauheena, myrkyllinen
Mangaanioksidia tulee lisätä vähintään 1–6 %, kun halutaan värjätä lasitetta. Pelkistävä poltto ei muuta eikä paranna mangaanioksidista saatavaa väriä. Yli 6–8 % lisäykset alkavat metalloida lasitetta mustaksi himmeäksi pinnaksi.
Mangaanioksidia käytetään mangaani- ja alumiinioksidiyhdisteinä matalanpolton alueella toimivissa vaaleanpunaisen sävyisissä pigmenteissä.
Nikkelioksidi NiO
Nikkelioksidi on voimakas väriaine, joka antaa vaaleanruskean värisävyn. Lasitteen kemiallisesta koostumuksesta riippuen nikkelillä saadaan lasitteesta myös jäänsinistä, turkoosia ja vihreää. Usein nikkelioksidilla pehmennetään liian kirkkaita ja voimakkaita värisävyjä. Nikkelillä saadaan jäänsinistä väriä lasitteissa, joissa on sulattajana huomattavan paljon sinkkiä (vähintään 0,4 RO-ryhmässä). Nikkelioksidia käytetään kidelasitteissa kiteen sydämenä, jonka ympärille kide alkaa kehittyä pitkän haudutusjakson (2–5 h) aikana.
NiO on nikkelimonoksidiksi, jota myydään keramiikan valmistukseen. Se esiintyy sekä mustana että vihreänä jauheena, jonka nikkelipitoisuus on n. 99 %. Nikkelioksidin vaikutus muuttuu epätasaiseksi yli 1200 °C asteeseen poltettaessa ja se eriytyy lasitekoostumuksesta. Se voi lisäksi aiheuttaa liian korkealle poltettuna lasitteeseen vaahtoa. Nikkeli on erittäin myrkyllinen ja terveydelle vaarallinen kaikissa muodoissaan.
Nikkelioksidin muotoja ja niiden värit jauheena ovat
- NiO (nikkelioksidi): vihreä tai musta jauheena, myrkyllinen
- Ni2O3 (nikkeli(III)-oksidi): musta jauheena, myrkyllinen
- NiCO3 (nikkelikarbonaatti): vaaleanvihreä jauheena, myrkyllinen
Nikkelioksidia käytetään harmaan pigmentin yhtenä osallisena oksidiyhdisteestä (koboltti-nikkeliharmaa). Sitä käytetään sävyttäjänä, värin muokkaajana (modifioijana) mustassa pigmentissä.
Oksidien käyttö
Oksideja käytettäessä tulee muistaa työturvallisuus. Alla olevassa kuvassa näkyy oksidien vaikutus ihmisen eri osiin.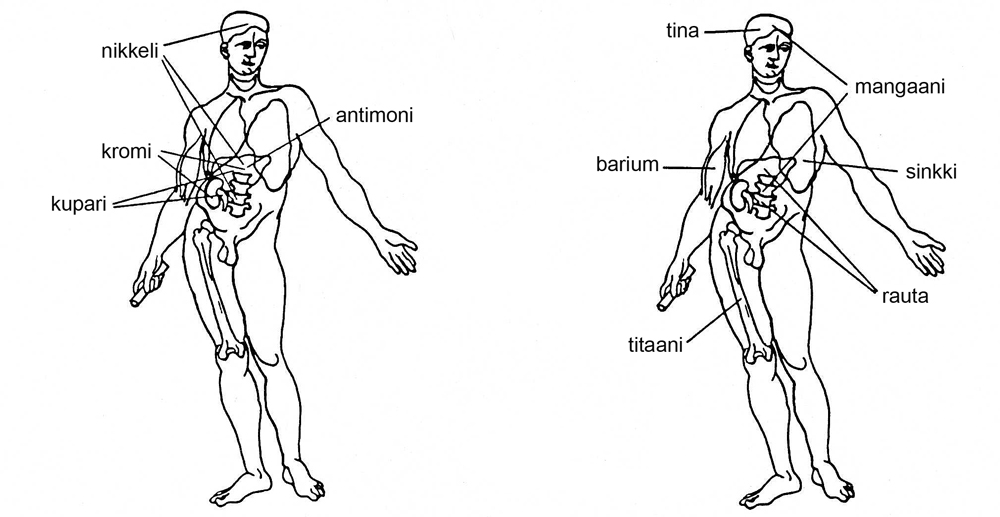
Kuvat
Hortling, Airi. Oksidipurkkeja.
Ceramic Review 1990. Oksidien vaikutus ihmiseen.